澳洲医疗器械TGA注册返回 Back
澳洲医疗器械TGA注册

TGA, Therapeutic Goods Administration,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。TGA开展一系列的评审和监督管理工作,以确保在澳大利亚提供的治疗商品符合适用的标准,并保证澳大利亚社会的治疗水平在一个较短的时间内达到较高的水平.
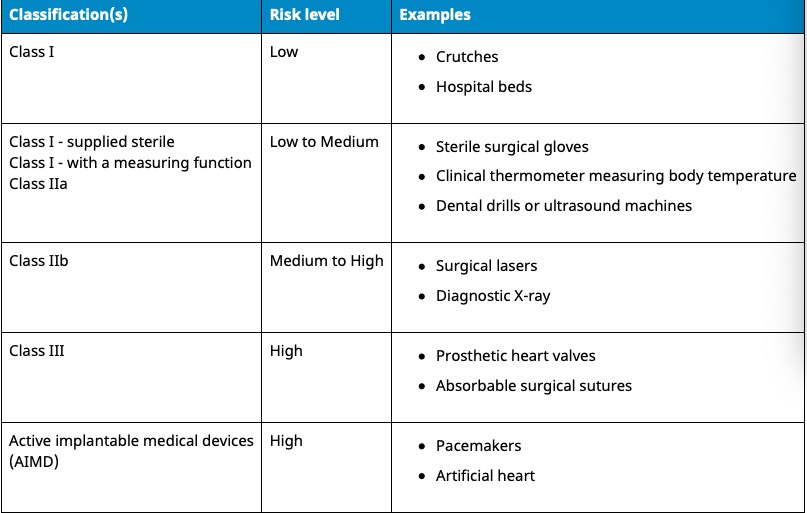
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果贵公司产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。
在澳大利亚供应医疗器械程序 - 所有的I类非无菌和非测量器械
a. 制造商准备必要的技术文件和澳大利亚的符合性声明
b. 主办者通过 TGA 递交在ARTG登记申请
c. 医疗器械制造商在ARTG和TGA登记后通知主办者
d. 主办者从电子业务系统打印出登记证书
e. 器械上市后持续监控
在澳大利亚供应医疗器械程序 - 如果医疗器械是在澳大利亚制造的(即I类消毒; I类测量; IIa类; IIb类,第III类,AIMD类)
a. 制造商决定质量规程,用于证明器械符合相关的基本原则,并准备必要的文 件
b. 制造商申请TGA合格评定证shu
c. 制造商准备澳大利亚符合性声明
d. 主办者向TGA提交制造商的证据
e. 主办者递交在ARTG登记申请
f. 在ARTG登记后主办者可以在澳大利亚供应器械
g. 器械上市后持续监控
在澳大利亚供应医疗器械程序 - 如果医疗器械是在海外制造的(即I类消毒; I类测量; IIa类; IIb类,III类,AIMD类)
a. 制造商从TGA或欧盟的认证机构获得合格评定证据
b. 制造商准备澳大利亚符合性声明
c. 主办者向TGA提交制造商的证据
d. 主办者递交在ARTG登记申请
e. 在ARTG登记后主办者可以在澳大利亚供应器械
f. 器械上市后持续监控
证书样本:


自我宣告样本:


