台湾行政院卫生署食品药品管理局(Taiwan Food and Drug Administration,简称TFDA),负责监管在台湾上市的医疗器械,换言之,所有本土和境外医疗器械制造商希望在台湾上市其医疗器械,必须获得TFDA的注册批准。
台湾注册咨询
台湾的医疗器械由食品药品监督管理局(TFDA)监管,隶属卫生和福利部(MOHW)。监管框架以《医疗器械法》为基础。
注册流程概述
监管流程由两个主要部分组成:
1.器械监管审查和批准:监管途径由分类和是否存在判定器械共同决定。没有谓词的器械被视为新器械,将接受TFDA医疗器械委员会的额外审查。设备注册申请提交并获得批准后,将向台湾代理商发放注册许可证。某些I类低风险设备有资格获得简化列表,而不是常规注册途径。
2.制造商注册或质量体系文件(QSD)批准:制造商必须提交QSD文件(如制造商信息和质量体系证书)以供审查,并在设备在台湾上市前获得QSD证书。列在TFDA豁免清单上的I类非测量和非无菌器械不在此要求之列。
注册准备和提交
作为此建议的一部分,将执行以下步骤来获得您的设备的注册:
1.珩渥将与您合作编译设备技术文件。珩渥将提供注册清单、适用的模板以及如何满足要求的指导。所有文件必须以英文或繁体中文提供。
2.珩渥将向TFDA提交完整的技术文件以供审查。
3.TFDA将对设备申请进行行政审查,以确保所有要求的要素都到位。随后将进行技术审查。我们将努力根据要求对TFDA作出回应。TFDA将发出最多两个“补充文件请求”。
4.一旦所有的补充文件请求得到处理,TFDA将发布许可批准的通知,并在其网站上公布批准。珩渥还将从TFDA获得原始许可证。

台湾医疗器械管理制度始于1970年制定公布的《药物药商管理法》,其中第五条说明医疗器械包括诊断、治疗、减轻或直接预防人类疾病,或足以影响人类身体结构及机能的仪器、器械、用具以及附件、配件、零件。该法在1993年将名称改为《药事法》,至今经过多次修正;对医疗器械的最新定义为第十三条:本法所称医疗器械,包括诊断、治疗、减轻或直接预防人类疾病或足以影响人类身体结构及机能的仪器、器械、用具以及附件、配件、零件台湾医疗器械管理制度始于1970年制定公布的《药物药商管理法》,其中第五条说明医疗器械包括诊断、治疗、减轻或直接预防人类疾病,或足以影响人类身体结构及机能的仪器、器械、用具以及附件、配件、零件。该法在1993年将名称改为《药事法》,至今经过多次修正;对医疗器械的最新定义为第十三条:本法所称医疗器械,包括诊断、治疗、减轻或直接预防人类疾病或足以影响人类身体结构及机能的仪器、器械、用具以及附件、配件、零件台湾医疗器械管理制度始于1970年制定公布的《药物药商管理法》,其中第五条说明医疗器械包括诊断、治疗、减轻或直接预防人类疾病,或足以影响人类身体结构及机能的仪器、器械、用具以及附件、配件、零件。该法在1993年将名称改为《药事法》,现为台湾行政院卫生署对医疗器械进行监督和管理的法律依据。
卫生署于2003年8月1日医疗器械审议委员会中决议建立医疗器械标准采用的机制,采用的标准范畴将以中华民国国家标准(CNS)、欧盟认可标准 (EN)及FDA 采认的标准为主,利用委员会讨论模式进行标准筛选。

有意在台湾销售产品的医疗器械公司必须达到台湾食品药物管理局(TFDA)的注册登记申请要求。 要想进入台湾市场,所有类别的医疗器械都需要先获得上市前审批。 我们在台北设有办事处,可以在TFDA注册申请流程的各个方面提供协助,包括申请材料的准备与提交,以及本地代理服务等。

在台湾,医疗器械是如何分类的?
对您的医疗器械进行正确分类是在台湾对医疗器械进行注册的第一步。 台湾监管体系根据医疗器械的风险性将其划分为I类、II类或III类。 其中II类和III类器械在进行台湾注册之前必须要有原产国的审批手续。
TFDA医疗器械注册有什么样的要求?
对于I类医疗器械,必须向TFDA提交一份注册登记申请进行审批。 II类和III类医疗器械也需要提交一份包括技术信息、产品测试报告和任何必要的临床数据在内的申请材料。
此外,针对许多医疗器械,TFDA还要求申请人在进行注册登记前,必须先获得质量体系文件(QSD)证明。
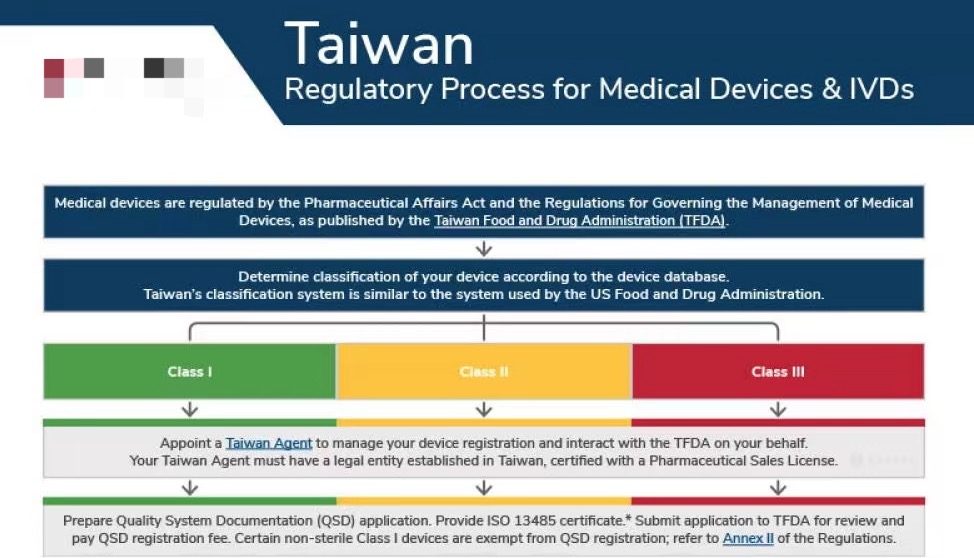
我们是否需要本地代理才能在台湾销售我们的医疗器械?
假如您的公司不在台湾,那就必须委任一名台湾代理人来处理您的医疗器械注册事宜。

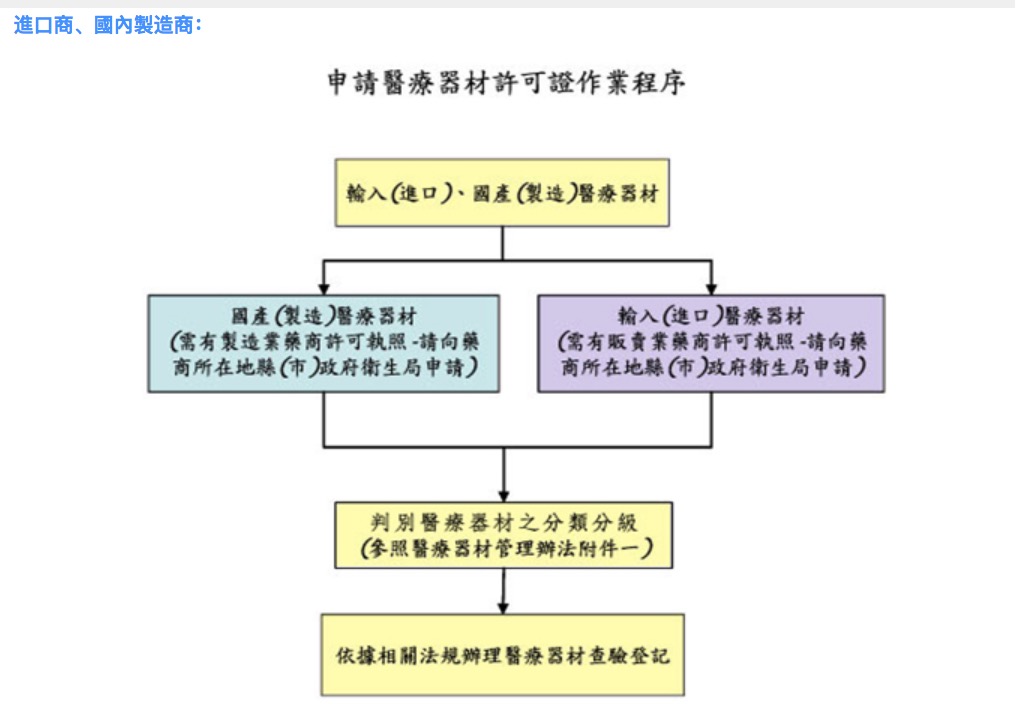
判斷是否屬列管之醫療器材?
若產品非屬醫療器材範疇,無須辦理醫療器材查驗登記。可先至衛生署食品藥物管理局,查詢台灣醫療器材分類分級之「鑑別」,產品若符合任一分類項目即屬醫療器材列管。
若為輸入產品,可參考輸入國家之規定,如詢問原製造廠該國是否將此產品列入醫療器材管理,但為參考用,仍應以我國規定為主。
如仍不能確定時,我司提供服務為客戶提出「列管查核」至衛生署進行判定產品是否屬於醫療器材列管範圍。
若輸入產地為中国大陸醫療器材,需先取得經濟部國際貿易局准許輸入之證明文件,才可以申辦查驗登記。
判斷醫療器材分類分級?與有無類似品?

第2、3等級醫療器材申請查驗登記時,需提供1-2個最相似的類似品資料,包括其標仿單核定本、使用說明書或製作產品比較表。
無類似品者即屬新醫療器材。第2等級無類似品者,可至衛生署食品藥物管理局參考公告「第二等級且無類似品醫療器材查驗登記申請之簡化流程」。
不同等級之送件方式
第一等級(Class I)(含一般醫材及IVD醫材): 所需文件:
第一等級醫療器材查驗登記申請暨切結書。
藥商執照影本。 *台灣業者:製造業藥商許可執照影本,若為委託製造,應另附申請者販賣業藥商許可執照影本
*國外業者:需販賣業藥商許可執照影本。
如為委託製造須檢附委託者與受託者簽訂之委託製造合約書。
如需符合GMP/QSD者需提出效期內認可登錄文件。

第二、三等級(Class II/III)(含一般醫材及IVD醫材): 所需文件:
第二、三等級申請醫療器材查驗登記案件送審表
第二、三等級申請醫療器材查驗登記案件資料表
醫療器材製造輸入查驗登記申請書(正、副本)各1份
相關行政文件、技術文件及測試報告。

IVD產品另需參閱「體外診斷醫療器材查驗登記須知」
我们可以为您提供以下帮助:
- 我们可以帮助您对您的医疗器械进行正确分类,以确保您的注册申请过程顺利进行。
- 我们可以收集整理必要的文件资料,以便进行注册申请与设计资料提交。
- 通过台湾代理人服务,我们可以代表您向TFDA提交申请文件资料,并负责与其之间的联络事宜。
- 我们经验丰富的QMS顾问可以在QSD认证证书、FDA QSR(21 CFR第820部分)以及13485合规性方面为您提供协助。

