Norm refer 涉及认证:SQM沙特阿拉伯质量标志, 沙特MDMA医疗器械注册,沙特SFDA医疗器械注册, 沙特化妆品eCosma注册...
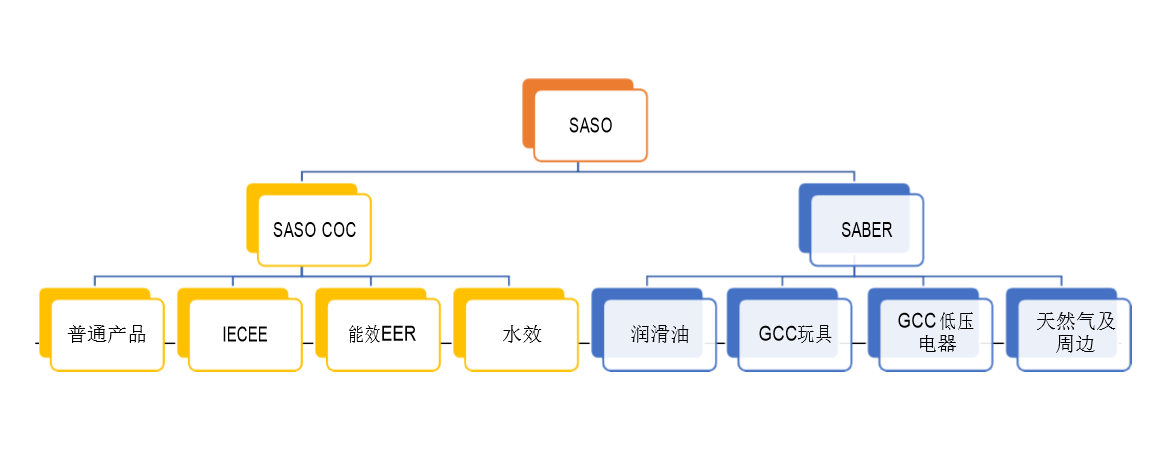
Saudi Arabian Standards Organization(SASO) 是沙特阿拉伯的一个技术政府机构,成立于 1972 年,负责管理与标准、计量和质量相关的任务。SASO由商业和投资部长领导的董事会管理,以及王国对标准化感兴趣的部门的成员。
SASO的职责主要集中在商品和服务的国家标准的设计和批准。其任务还包括发布法规,以确保根据批准的标准对商品,产品和服务进行评估程序。提高对标准和质量的认识,进行研究和调查也涉及SASO的责任。
SASO对以下领域发布了沙特标准:
-电气和电子产品
-机械和金属产品
-纺织产品
-度量衡
-质量控制和符合性
-信息和文档
-服务标准
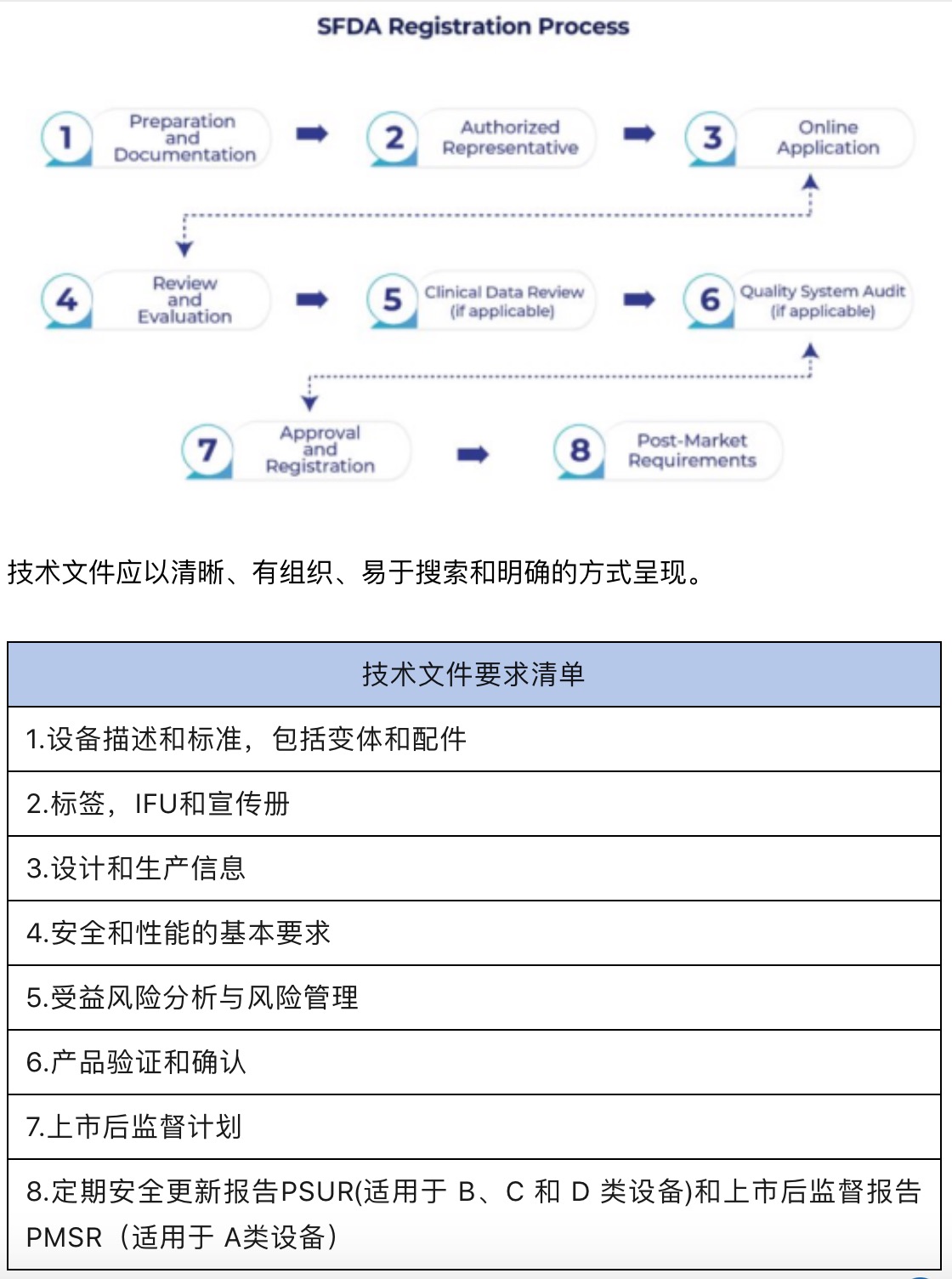
沙特食品药品监督管理局(SFDA)
负责监管沙特阿拉伯的医疗器械产品, 确保其安全、有效和质量稳定。所有医疗器械产品在销售产品之前必须获得SFDA批准的医疗器械上市授权medical devices marketing authorization (MDMA)。产品批准后,SFDA负责产品安全和整个生命周期管理,如MDMA变更、续证、上市后监督活动等。
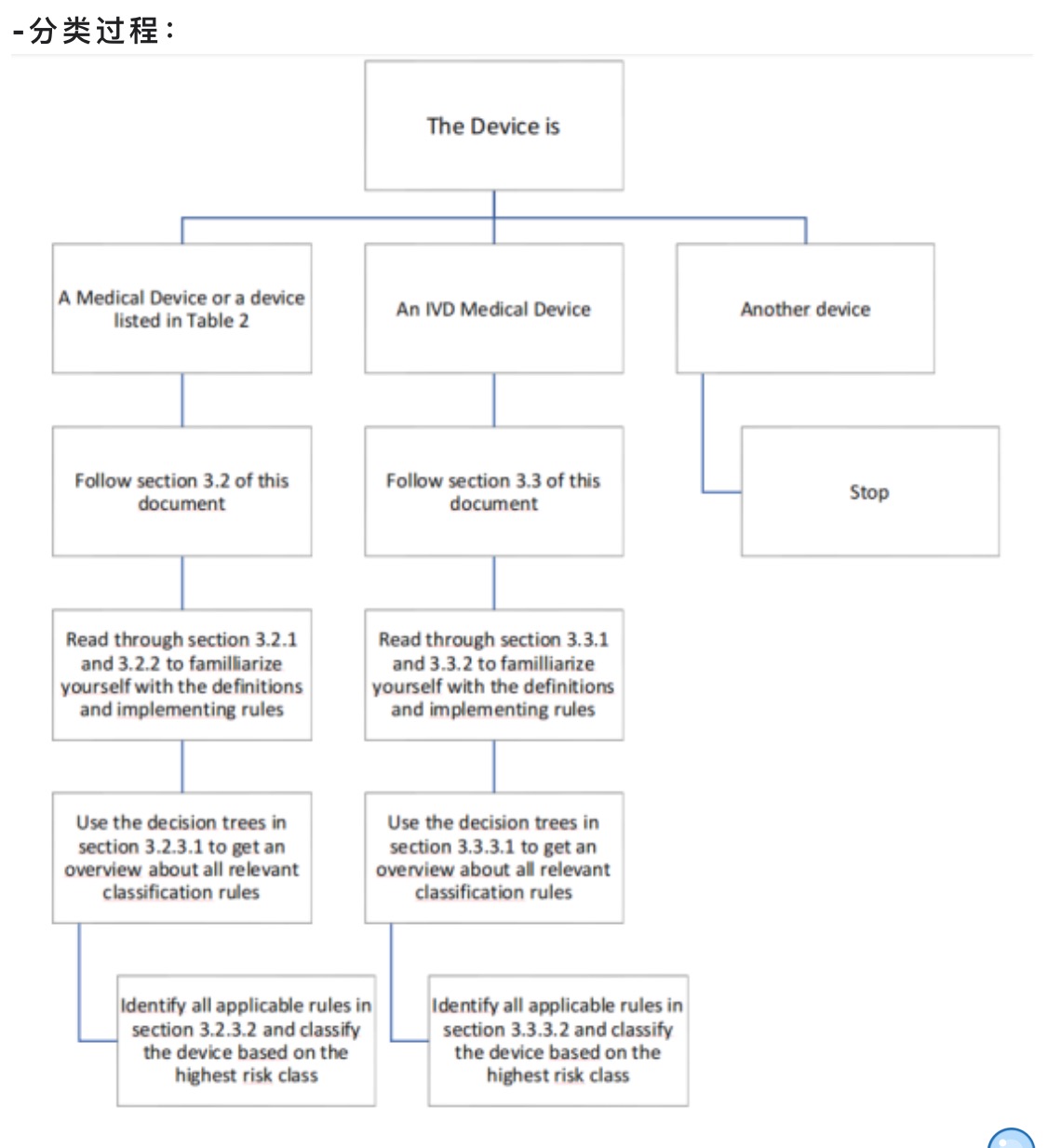
制造商负责根据以下条件使用一组分类规则来确定设备的分类
·制造商对设备的预期用途
·对患者、使用者和其他人的风险水平(伤害发生的概率以及伤害的严重程度)
·对人体的入侵程度
·使用期限
如果相同的装置要在身体的不同部位使用,则可以进行不同的分类。因此,制造商对
该设备的预期用途对于确定适当的分类至关重要。预期用途可从:
·使用说明书(IFU)
·标签
·制造商的广告材料
·技术文件
SFDA的职责和权限:
1. 研究和确认申请人的申请资料是否充分、适当并符合全部要求。
2. 开展机构检查以确保满足所有要求。
3. 通知机构已收到机构许可所需的信息并且已满足许可要求。
4. 在许可过程中,SFDA审核员或合同审核员应对信息保密。
5. 按照附件(2) 的规定确定每个医疗器械经营机构颁发许可证的费用。
6. 评估满足所有要求后颁发机构许可证,有效期为一年或类似的可更新期限。
7. 拒绝不符合所有要求的机构许可申请,并将拒绝理由通知申请人。
8. 定期监督检查,确保机构遵守SFDA法规要求。
9. 对玩忽职守、违反或者操纵SFDA法律、法规或者要求的行为,SFDA应采取合适的措施,按照医疗器械法及其实施条例的规定进行处罚和罚款。
10. 调查机构或其受益人提交的任何投诉,并确保根据以下程序对其进行客观评估。
11. 承诺在SFDA网站上公布所有获得许可的机构名单及其活动内容声明。
医疗器械相关机构的许可要求:
希望从事任何受法律约束的活动(包括电子活动)的机构, 包括其分支机构和仓库,应从SFDA获得机构许可证,符合如下一般要求:
1.在向SFDA申请许可证之前,有义务遵守所有要求、条件和法律程序,并提供合规证据。
2. 每个机构都应有一个符合KSA法规的法律实体/或是法律实体的一部分,被视为对其活动和决定负有法律责任。
3. 所有A类和B类别的制造商、进口商和经销商应根据沙特标准(SFDA.MD/GSO ISO 13485)或同等标准,从SFDA认可的医疗器械合格评定机构(CAB)获得质量管理体系证书。
注:SFDA认可的合格评定机构是指那些在沙特境内开展活动并获得SFDA许可的机构,或那些位于沙特境外并经国际认证论坛(IAF)认可的机构
4. 所有C类和D类别的授权代表、进口商和经销商应提交质量管理体系的实施证据或SFDA的检查报告,以确认其符合沙特标准(SFDA.MD/GSO ISO 13485)或同等标准的质量管理体系要求。
5. 跟进SFDA发布的所有与规则、条例、条件、要求、通知、指导和指示有关的信息,以及在SFDA网站上发布的任何修订或更新,并将其告知受益人和相关机构。
6. 许可证续期申请可在有效许可证到期日(60天)前提交。
7. 若要取消许可证,在许可证到期日前或不愿意续订许可证时,机构应通过“GHAD”系统提交申请并通知SFDA,同时提供对该机构没有义务的证明。
8. 所有医疗器械的广告和宣传材料,除非按照SFDA网站上发布的广告的批准要求获得SFDA的批准,否则不得进行推广。
9. 遵守医疗器械上市后监督要求,包括但不限于:
(1)向中心通报/报告医疗器械事故,并向中心提供所有必要的信息和文件,包括供应和分发数据
(2)根据中心批准的时间计划,向中心通知/报告影响沙特的安全警报。
(3)确定影响沙特的安全警报相关风险,并提供供应和分销信息
(4)提供指定执行结束日期的纠正措施实施计划
(5)根据中心批准的计划提供安全警报实施完成的证明
沙特授权代表(AR)需满足的要求:
1.沙特本地公司
2. 在沙特境内的每个机构获得单独的许可证
3. 确保没有为同一类或一般医疗器械指定其他授权代表
4. 执行分配给他的任务的必要过程的文件以及相关文件的附件。
5. 与制造商达成的协议应记录在案,并经批准,并符合沙特的法规。
6. 与制造商的协议应至少包括以下信息:
(1)规定授权代表代表制造商与SFDA进行交易的活动
(2)根据《医疗器械法》和《行政法规》在沙特销售的医疗器械类型或组合
(3)授权代表应遵守SFDA网站上公布的上市后监督的所有要求
(4)确定双方之间的协议期限,其中一方可根据以下规定终止协议:
(i)为了终止本协议,制造商应向授权代表发出书面通知。
(ii)制造商应任命一名新的授权代表,并在之前的授权代表协议终止或不续签后立即将之前的所有义务转移给他,并应通知SFDA。
(iii)为了终止本协议,授权代表应向制造商发出书面通知。
授权代表(AR)的义务和责任:
2. 授权代表应配合SFDA开展上市后监管活动。
3. 授权代表应向SFDA通报在沙特境外发生的,对在沙特境内流通的医疗器械有影响的任何事件。授权代表应说明情况并提供制造商已采取或拟采取的纠正措施的信息。
4. 授权代表应通知SFDA由制造商开展的关于沙特境内的医疗器械的任何调查所产生的所有纠正措施。授权代表应解释采取纠正措施的原因,并提供由制造商已采取或打算采取的措施的信息。
5. 授权代表应根据《医疗器械法》及其条例的规定,与从事有关在沙特流通的医疗器械的活动者进行合作。这应记录在授权代表和制造商之间的协议中。
6. 在协议中规定的授权代表对医疗器械的责任不因授权代表要求终止协议而终止,除非制造商指定其他授权代表替代,或者该医疗器械不再在市场上进行流通或者使用。
7. 当有必要终止协议时,授权代表应书面通知制造商和SFDA。
授权代表应提供SFDA要求的任何信息或相关文件。
Sample for reference 参考图片:

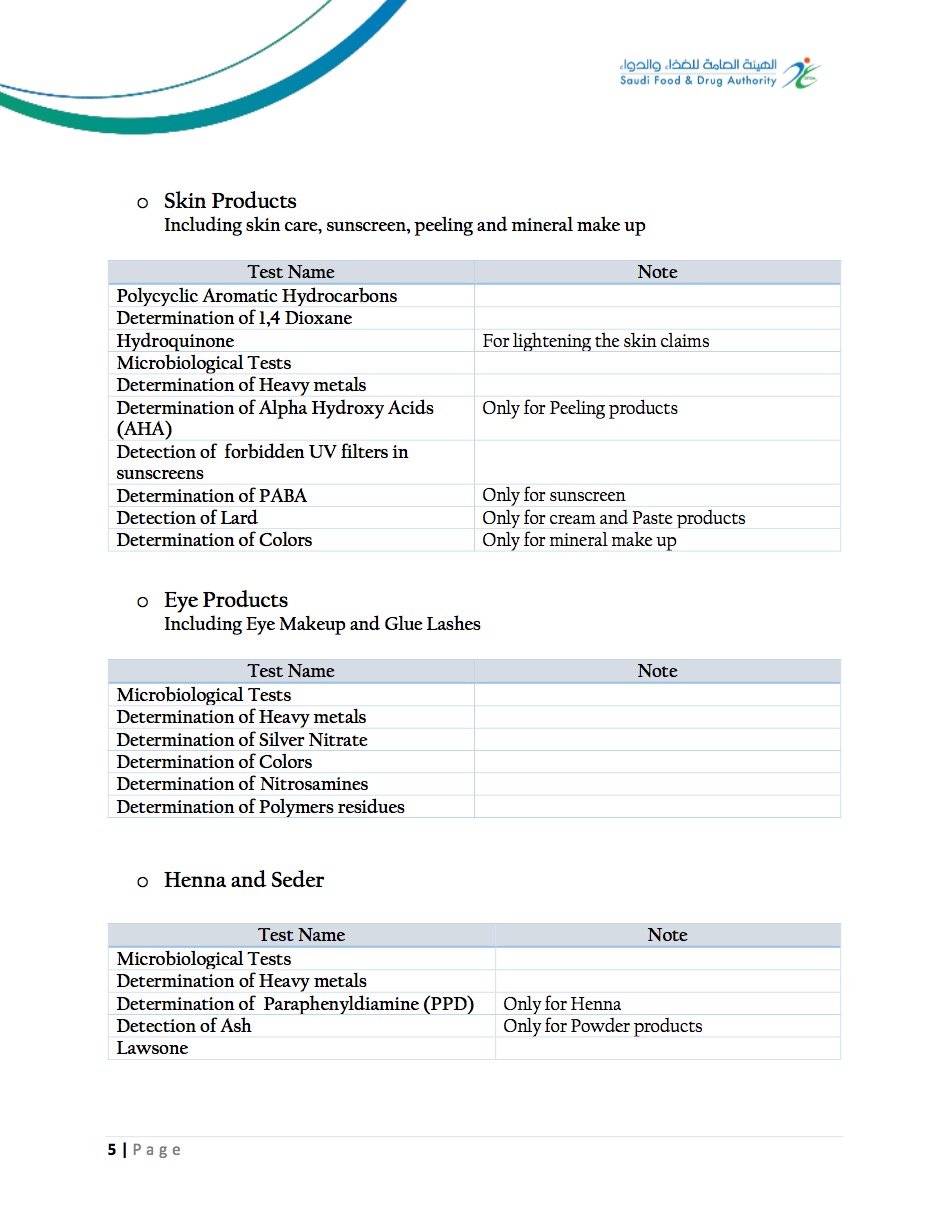
SFDA对于化妆品的测试管控要求如下



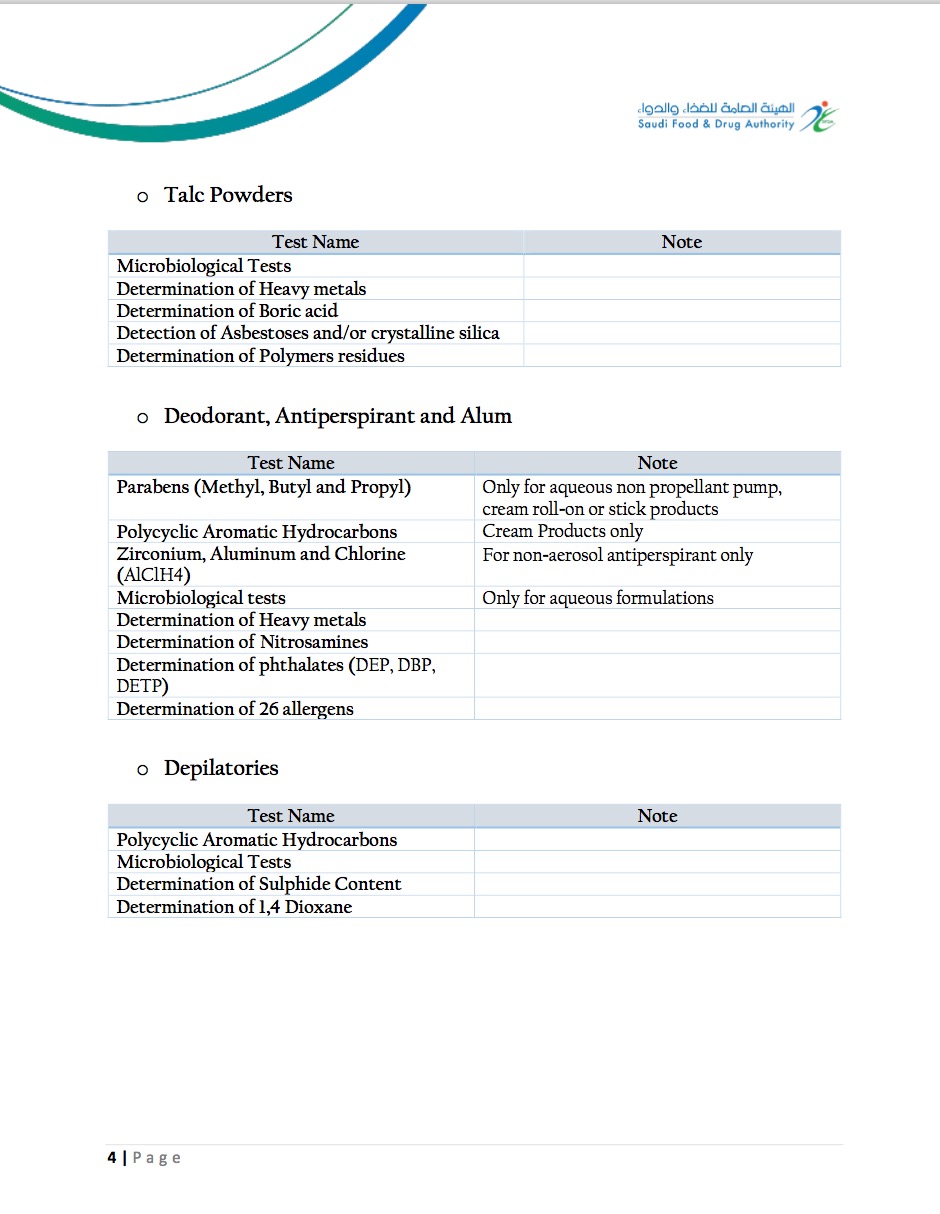

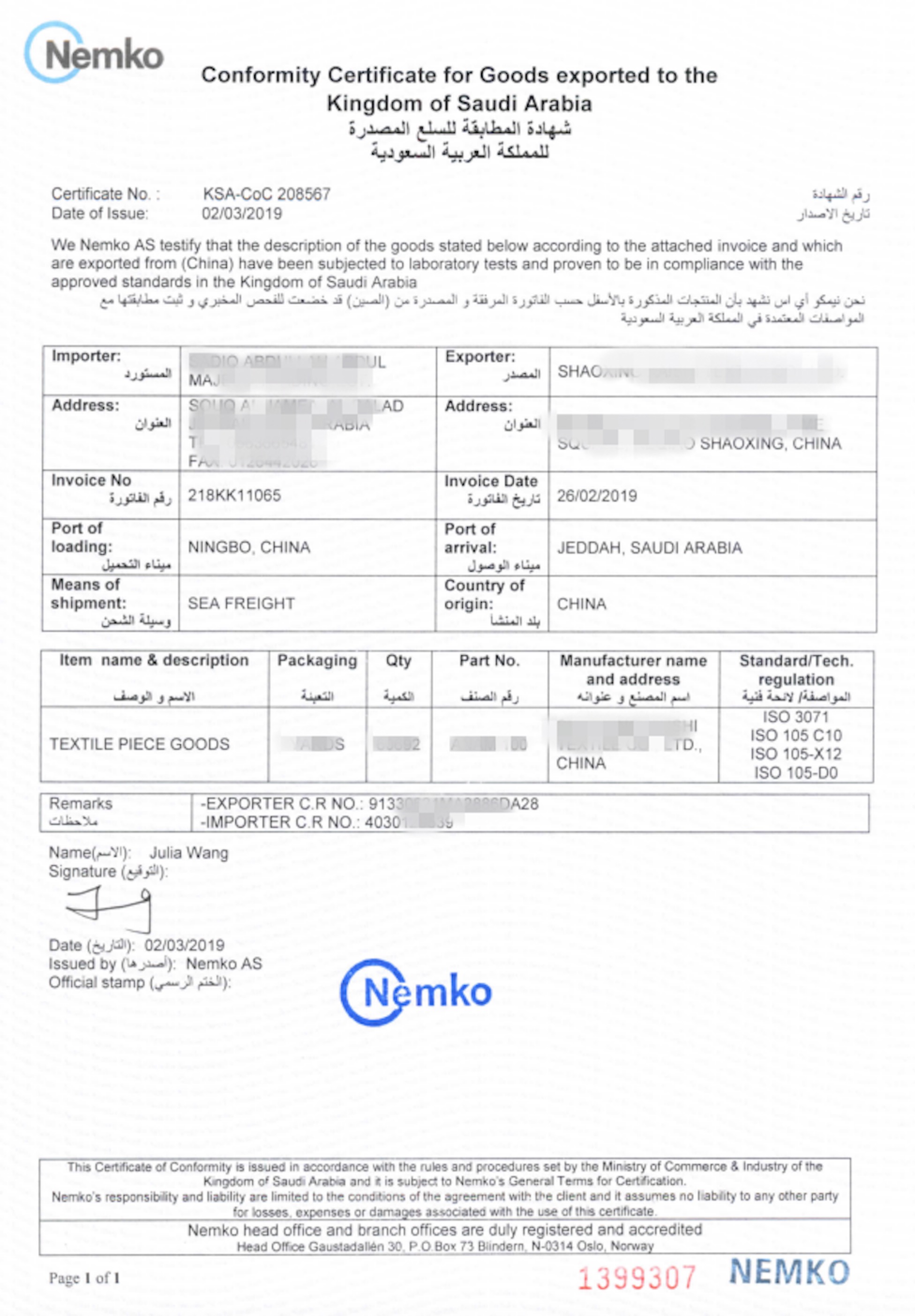
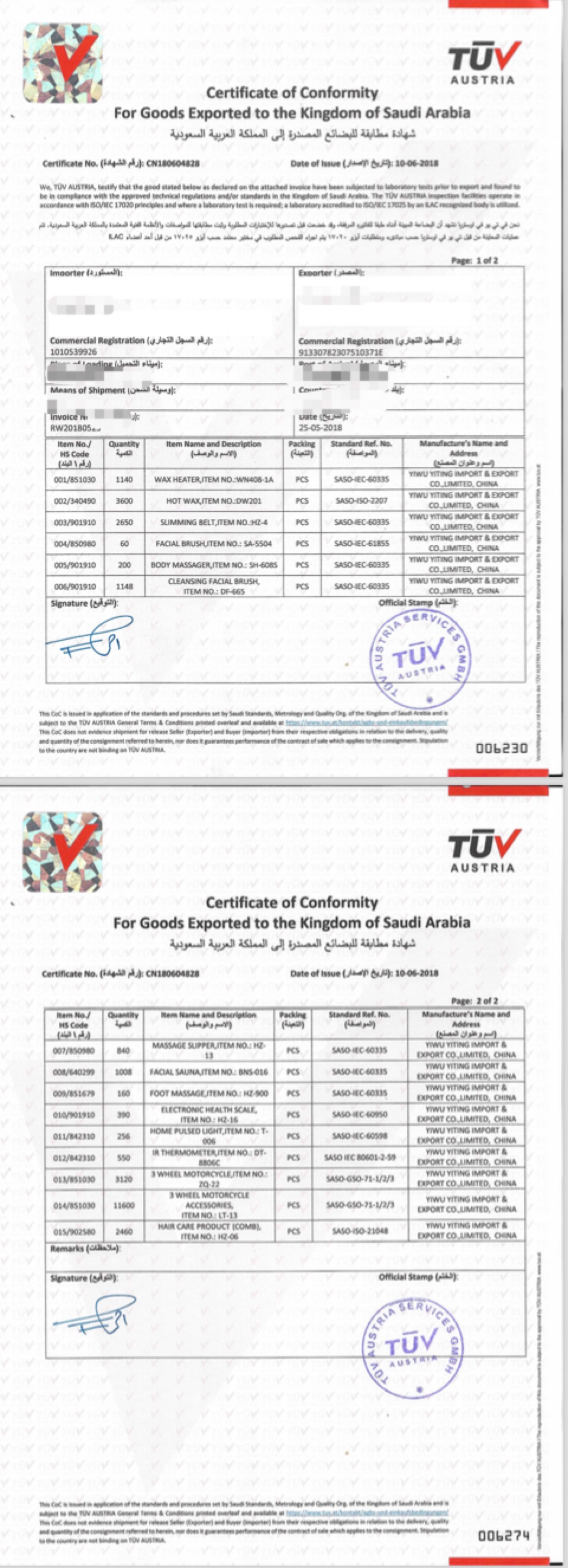
Sample Report 报告样本:
| Countries/Regions | 国家/地区 | 服务项目(Services) |
| Algeria | 阿尔及利亚 | 产品符合性评定方案Product Conformity Assessment,简称PCA |
| Burundi | 布隆迪 | 装船前符合性评定方案Pre-Shipment Verification of Conformity,简称PVoC |
| Cameroon | 喀麦隆 | 装船前符合性评估方案Pre-Shipment Evaluation of Conformity,简称PECAE |
| Egypt | 埃及 | 进出口管理评定方案Export and import control certification program |
| Ethiopia | 埃塞俄比亚 | 产品符合性评定方案Product Conformity Assessment,简称PCA |
| Gabon | 加蓬 | 加蓬符合性评定方案The Gabonese Program of Conformity,简称PROGEC |
| Haiti | 海地 | 产品符合性评定方案Product Verification of Conformity Program,简称PCA |
| Ivory Coast | 科特迪瓦 | 产品符合性评定方案Inspection and Verification of Conformity Program 简称VoC |
| Kenya | 肯尼亚 | 出口前符合性评定方案Pre-Export Verification of Conformity,简称PVoC |
| Kuwait | 科威特 | 科威特标准保障方案 Kuwait Conformity Assurance Scheme,简称KUCAS |
| Mongolia | 蒙古 | 符合性评定方案Conformity Assessment SERVICES,简称CAS |
| Nigeria | 尼日利亚 | 尼日利亚标准组织符合性评定方案Standards Organisation of Nigeria Conformity Assessment Programme,简称SONCAP |
| Qatar | 卡塔尔 | 装船前符合性评定方案Pre-Shipment Verification of Conformity,简称PVoC |
| Saudi Arabia | 沙特阿拉伯 |
产品符合性评定方案Product Conformity Assessment -- SASO Program & SFDA Program -- including certificates issued through SABER platform -- Quality Mark 简称SQM |
| Uganda | 乌干达 | 出门前符合性评定方案 Pre-Export Verification of Conformity,简称PVoC |
| United Arab Emirates | 阿联酋 |
阿联酋符合性评定方案 EMIRATES CONFORMITY ASSESSMENT SCHEME,简称ECAS(by ESMA) |
| Zanzibar | 桑给巴尔 | 出口前标准符合性评定方案 Pre-Export Verification of Conformity to Standards,简称PVoC |
| Libya | 利比亚 | 商业性装船前检验 Pre-Shipment Inspection,简称PSI(Commercial) |
| Indonesia | 印度尼西亚 | 装船前检验 Pre-Shipment Inspection,简称PSI |
| Uzbekistan | 乌兹别克斯坦 | 装船前检验 Pre-Shipment Inspection,简称PSI |
