
NMRA在医疗器械审批中的范围和责任
国家药品监管局(NMRA)负责建设一个更健康的国家,以确保在斯里兰卡供应的医疗设备具有可接受的质量、安全性并符合其预期目的。
因此,凡属上述定义类别的医疗仪器,均应向管理局注册,并须取得许可证,以便在斯里兰卡制造、进口、再包装、销售、分销和出售。
所有外国医疗器械制造商应通过斯里兰卡的营销授权持有人(当地代理)申请注册,该代理人负责斯里兰卡特定医疗器械的注册、许可、进口、销售和分销、质量问题处理等所有方面。
并且代理人需持有CDDA证书

申请人/登记持有人(制造商或进口商)必须以书面声明
负责确保已注册设备的安全、质量和有效性
产品符合所有现有的法规和规格(标准)
职责包括
l 负责产品及所有支持其申请的信息
l 产品注册及更新与产品相关的任何信息
l 有效的程序处理可以避免在使用时发生的任何事件或信息影响产品。
l 执行适当的质量控制
l 确保使用适当的包装材料来保证产品的质量
如何申请样本(产品)牌照
为了申请样品许可证,申请人应该提交
•注册申请信
•商业登记证BR(1)
•由制造商出具的授权委托书,并指定申请人为当地代理相关产品
授权委托书应寄至CDDA总监处,并由该人签署(须指定制造公司总经理或首席执行官的名称)
另外,最好提供其他国家代理商的信息。
•免费销售证书复印件
如上述文件符合要求,申请人将会收到收款处发出的付款通知书
然后,他必须到中国财政部或卫生部的收款处支付相关款项。
连同上述相关文件,由卫生部发出黄色收据
应在收据上盖上日期后提交CDDA接收点。
然后,在接收点,申请将被输入到一个寄存器。
许可证样本会一式三份,有效期为一年
签发日期及申请人可在签收点领取。(若需要额外的一份证书,会随档案附上)
然后当地代理可以提交档案

提交的应用程序
提交申请书须符合下列要求
-应用程序应该在一个盒子文件
-准备三份独立的文件
-首页应包含以下详细信息
如。
认可的名称,品牌名称,制造商的详细资料,进口商的详细资料。
-应用程序应编号插入脊髓灰质炎号码从上到下和从下到上
(1)基本要求
•指数
•确认书
•进口许可证样本复印件
•附表I形成规则4 (3)
申请人、制造商和进口商的名称和地址
2设备名称、品牌名称(如有)、官方或批准名称
3生产所在国卫生当局出具的证明以确认设备正在那里使用,以及使用期间,如果没有在生产国销售需提供原因(免费销售证书)-经a公司认证的免费销售证书的正本或副本
FDA/医疗器械控制机构/斯里兰卡大使馆或外交部可以接受的正本为承兑交单证明(是否有)
四、具有证明在其他国家注册状态的文件的国家清单
如。外国注册证书
五、设备包装完整的样品
申请人应能提交至少两个商业批次的样品发送外部评估者如。
用于无菌产品,单用户产品
仪器仪表提供了两个样品
如需机械设备及昂贵设备,应由当地代理商负责
当外部评估者需要时,向他们展示这些机器的描述
如果你拒绝申请那么相关样本的申请将不被接受及将不被寄到评估者)
六。标签的内盒和外盒样品
产品目录,以帮助产品的识别(很多没有)。、生产日期、有效日期、生产商名称、地址、国家
原产地应在标签上注明
注册流程
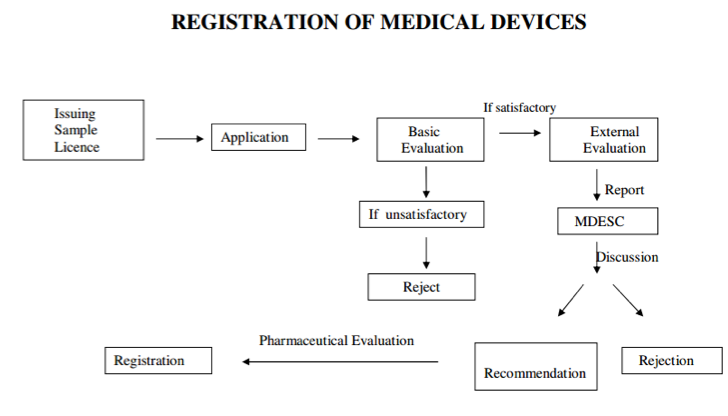
注册的有效性
•完整注册
装置的正式注册有效期为五年,并载于证书。
注册的续展每五年办理一次。
•临时登记
在某些情况下,临时注册的期限为一年
作为;——新设备
-设备的新规格——新的制造商
-在代理机构调动时
-因质量问题被暂停销售的产品
-没有提供上述所需文件的申请

