GRAS / NDI 注册返回 Back

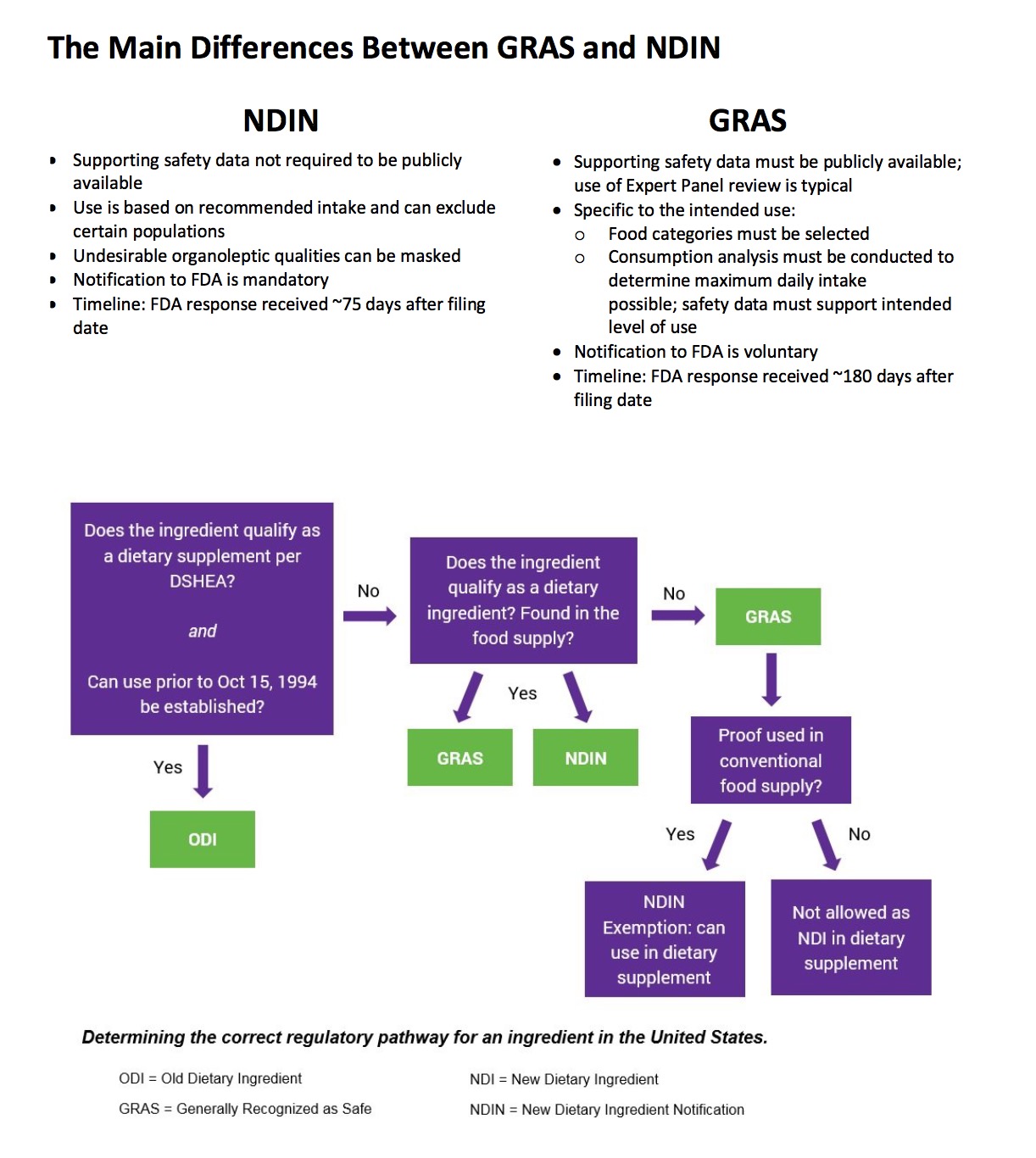
GRAS,Generally Recognized as Safe
GRAS 是美国 FDA 评价食品添加剂的安全性指标

GRAS(Generally Recognized as Safe),也就是“公认安全”, FDA对GRAS的定义并没有直接和单独的定义,仅是从食品添加剂的两步定义中提取出来的“间接”定义:“‘公认安全使用物质’是由经过科学训练并具有经验和资质的专家们,依据科学评估程序(或者对1958年1月1日之前已经开始使用的物质,可以使用科学评估程序,或者以在食品中普遍使用的经验为基础来加以确认)所显示的充分结果,从而确认在特定条件下使用是安全的。”

为确保食品添加剂的绝对安全使用,世界各国对各种食品添加剂能否使用、适 用范围和最大使用量,都有严格的规定,要受法规法律的制约。在国际上被公认的食品添加剂安全性指标有 LD50 GRAS 和 ADI 。LD50 LD50,GRAS LD50(大鼠,经口) 是判断食品添加剂安全性的常用指标,也是任何食品添加剂都必须进行的毒理 LD 学评价中的第一个阶段急性毒性试验指标 ,LD 越大表明其毒性越小,在食品使 用时其安全性越高,根据我国卫生部《食品安全性毒理学评价标准 》 1994 (1994 1994)的 毒性划分规定,苯甲酸和苯甲酸钠属于实际无毒类,而肉制品中常用作发色剂 G 的亚硝酸钠 LD 为 220mg/KG 220mg/KG,属于中等毒类。GRAS 是美国 FDA 评价食品添 加剂的安全性指标。根据 FDA 的规定,苯甲酸被列为一般公认的安全类食品添 ADI 加剂。ADI ADI(每日允许摄入量)值为每日人体每千克体重允许摄入的毫克数 , 数 值是由 FAO/WHO 1994 FAO/WHO(1994 1994)规定的,苯甲酸在食品中的使用量为 0.2 1g/kg 只 0.2-1g/kg 1g/kg。 要按照国标规定的添加量使用是不会有安全问题的。

NDI 新饮食补充剂成分 - New Dietary Ingredient Notifications and Related Issues,简称NDI Draft Guidance
根据美国联邦食品、药品及化妆品法令第21 U.S.C.350b(d)的规定,企业如果认为其将推出市场的膳食补充剂中,含有新的膳食成分(是指1994年10月15日之前未在市场出现过的成分),该企业必须在产品面市前最少75天,向监督管理局呈上报告书,提供该新成分的详细资料,并证明有理由预期该新成分对人体的吸收是安全的。

2011年, 美国FDA颁布了NDI指导草案(New Dietary Ingredient Notifications and Related Issues,简称NDI Draft Guidance),重新定义了“1994年营养补充剂健康教育法案(DSHEA 1994)”相关内容。根据“NDI Draft Guidance”,美国FDA对新饮食补充剂成分(New Dietary Ingredient,简称NDI)及其制成品,实行“预上市通知(Premarket Notification, PMN)”程序。
新饮食补充剂成分(New Dietary Ingredient, NDI)”,国内以往资料译为“膳食补充剂新成分”、“新膳食补充剂”、“新膳食配料”、“新饮食补充剂”等。

根据“NDI Draft Guidance”,在“DSHEA 1994”实施前(1994年10月15日以前),没有在美国作为“饮食补充剂成分(DI)”上市过的物质,如果作为饮食补充剂成分上市,而无论其此前是否作为“传统普通食品”成分使用过,均符合NDI的定义范畴,实行预上市通知程序。
美国食品市场准入条件十分严格,明确食品种类的同时,进入市场前进行备案。龙力低聚木糖已经在美国FDA GRAS NOTICE,NDI注册通过,符合美国“预上市通知(Premarket Notification, PMN)”程序,低聚木糖可以以“新饮食补充剂成分”进入美国市场。

申请流程:
1. 填写FDA表格
2. 编写NDI / GRAS报告,报告分成大概6个部分,其中包括:
GRAS EXEMPTION CLAIM,
INTRODUCTION ,
CHEMISTRY &
MANUFACTURING OF GLUCOSYLATED STEVIA (针对客户的产品),
SELF-LIMITING LEVELS OF
USE ,
BASIS FOR GRAS
DETERMINATION,
REFERENCES,
完整报告大致需要50-60页才能完全阐述产品的安全性和可靠性,
3. 等待FDA审核报告
4. 如果FDA无异议通过,GRAS 列名

美国FDA 对于GRAS 和 NDI的审批流程非常复杂,并且具有专业性。申报的通过率不高,而NDI拒绝率更是高达 88%。NDI的审批相较GRAS来说流程更长、要求更高、更具挑战性。美国每年有5500多种新的膳食补充剂产品上市,然而,在启动NDI至今的28年时间里,FDA仅受理了不到1300个NDI通知。而在每年提交的NDI认证申请中,FDA无异议回复(AKL)通过率只有39%
GRAS 与 NDI 的主要区别: