FDA批准药品 新药是否需要FDA批准取决于新药是否符合非处方(OTC)专论。
OTC专论确立了FDA预先确定药物安全有效的条件。一旦OTC专论成为最终版,药品企业可以在没有FDA批准的情况下销售符合专论的OTC药品
药品FDA认证流程
1.准备阶段
a.企业法人执照复印件;
b.生产(卫生)许可证,合格证复印件;
c.企业简介(成立时间,技术力量,主要产品极其性能,资产状况)。
2.技术初审申报受理
递交DMF(药物主文件)和SOP(标准操作程序)的英译本文件给代理商;根据代理商的意见,对上述文件进行修改。
3.DMF资料审阅
FDA认真审核,并到工厂实地考察,检查DMF文件所写是否属实;若FDA未发现重大差错,并认为符合要求,则提出预批准检查计划。
4.FDA检查
FDA检查官对工厂进行检查,提问,工厂必须一—回答;若有疑问,官员会给出“483”表(整改建议书),问题严重,则不给“483"表。
5.FDA签发“批准信”必须认真回答“483”表上检查官提出的问题,若有问题,必须立即改正并证明药品FDA认证流程
1.准备阶段
a.企业法人执照复印件;
b.生产(卫生)许可证,合格证复印件;
c.企业简介(成立时间,技术力量,主要产品极其性能,资产状况)。
2.技术初审申报受理
递交DMF(药物主文件)和SOP(标准操作程序)的英译本文件给代理商;根据代理商的意见,对上述文件进行修改。
3.DMF资料审阅
FDA认真审核,并到工厂实地考察,检查DMF文件所写是否属实;若FDA未发现重大差错,并认为符合要求,则提出预批准检查计划。
4.FDA检查
FDA检查官对工厂进行检查,提问,工厂必须一—回答;若有疑问,官员会给出“483”表(整改建议书),问题严重,则不给“483"表。
5.FDA签发“批准信”必须认真回答“483”表上检查官提出的问题,若有问题,必须立即改正并证明
洗手液的产品NDC个数的问题。
NDC号码对应的其实是品牌方+产品的成分+产品的规格。3者有任何一方有变动,都需要申请不同的NDC
原文信息如下:

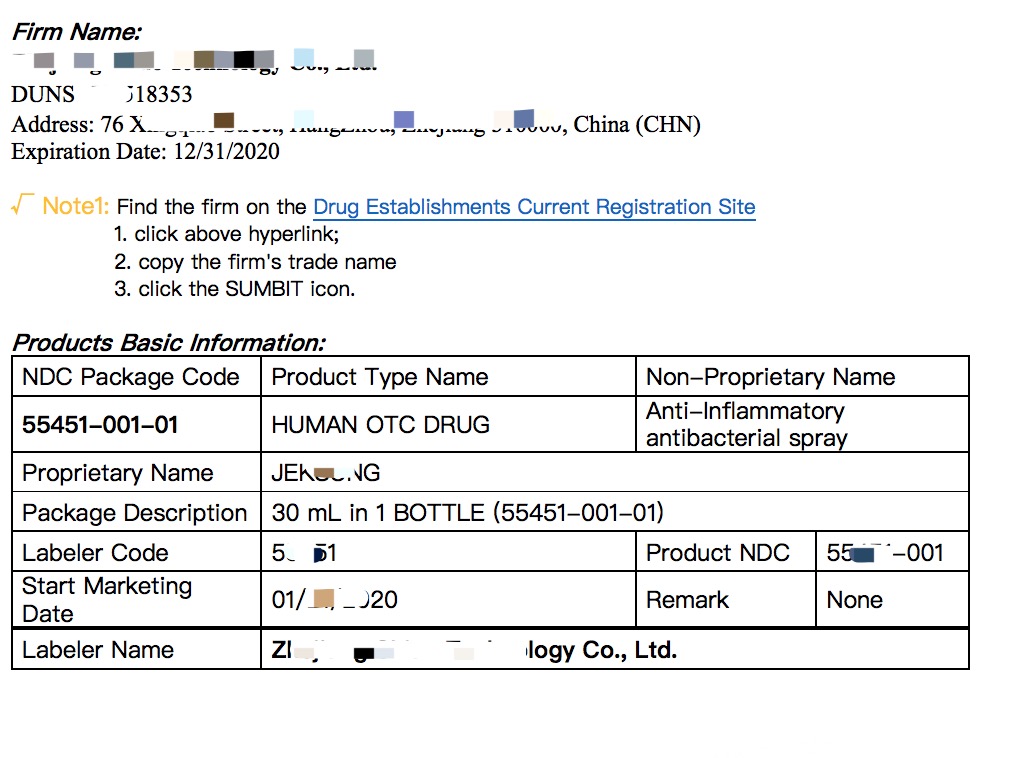
注册信息样本:
标签制作范本:

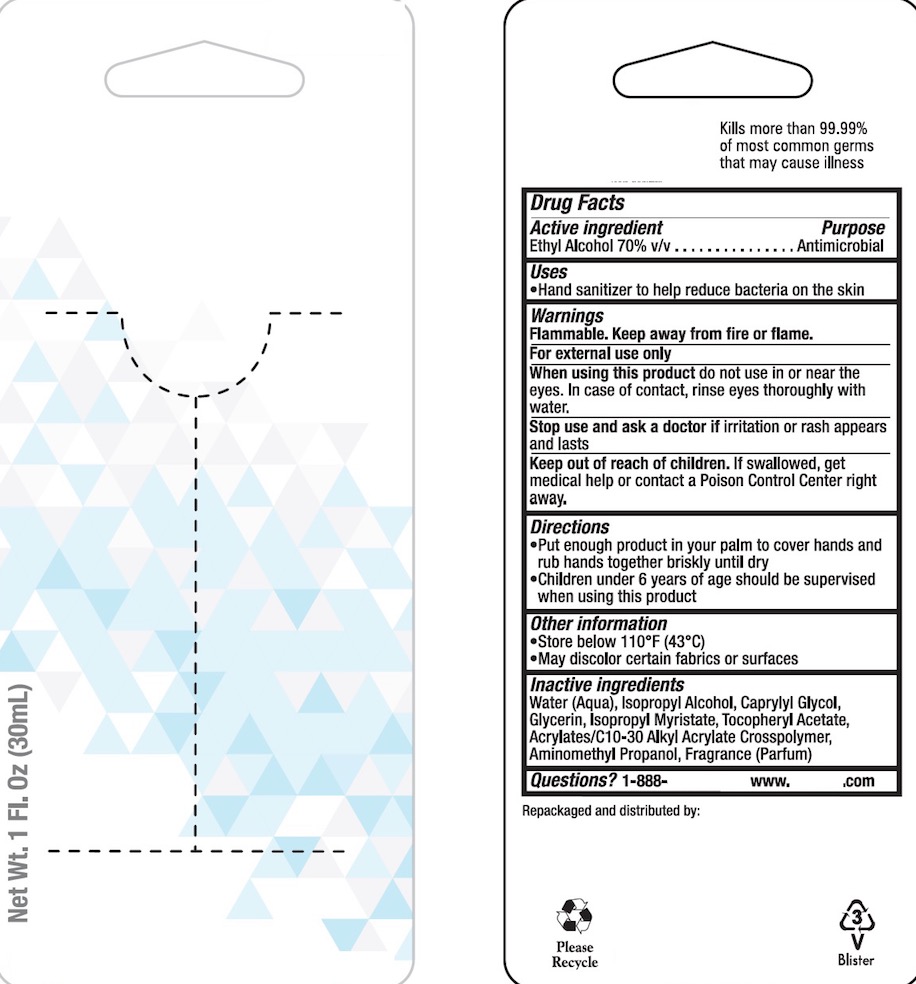
标签样本: