菲律宾的医疗器械注册

菲律宾医疗器械CMDN注册 - A类
菲律宾医疗器械CMDR注册 - B,C,D类
菲律宾医疗器械CDRRHR注册
有效期为 5 年

政府机关
菲律宾的医疗器械注册由卫生部内的器械监管、辐射健康和研究中心 (CDRRHR) 管理。为了根据东盟医疗器械指令协调菲律宾监管指南,菲律宾卫生部最近发布了 2018-0002 号行政命令。行政令引入了医疗器械的风险分类,以及对初始器械注册和更新的新要求。
医疗器械状态
提出治疗或医疗要求的仪器、机器、体外试剂、软件和类似或相关物品在菲律宾被视为医疗器械。
产品分类
当前的产品分类根据东盟医疗器械指令进行了协调,分为 A、B、C 和 D 四个等级,从低风险到高风险分类。新的审核时间和注册费用因风险类别而异:
A 类通知 (CMDN) 低等级 - 4 到 12 周,产品验证服务 - 政府管费 申请PhP7500, 评估PhP750, 年费PhP5,150
B 类注册 (CMDR) 中低等级- 180 天内,产品验证服务 - 政府管费 申请PhP7500, 评估PhP750, 年费PhP5,150
C 类注册 (CMDR) 中高等级 - 180 天内,产品验证服务 - 政府管费 申请PhP7500, 评估PhP750, 年费PhP5,150
D 类注册 (CMDR) 高等级 - 180 天内,产品验证服务 - 政府管费 申请PhP7500, 评估PhP750, 年费PhP5,150
IVD 不包括在此分类中。将针对体外诊断设备发布单独的行政命令。
设备符合性评估
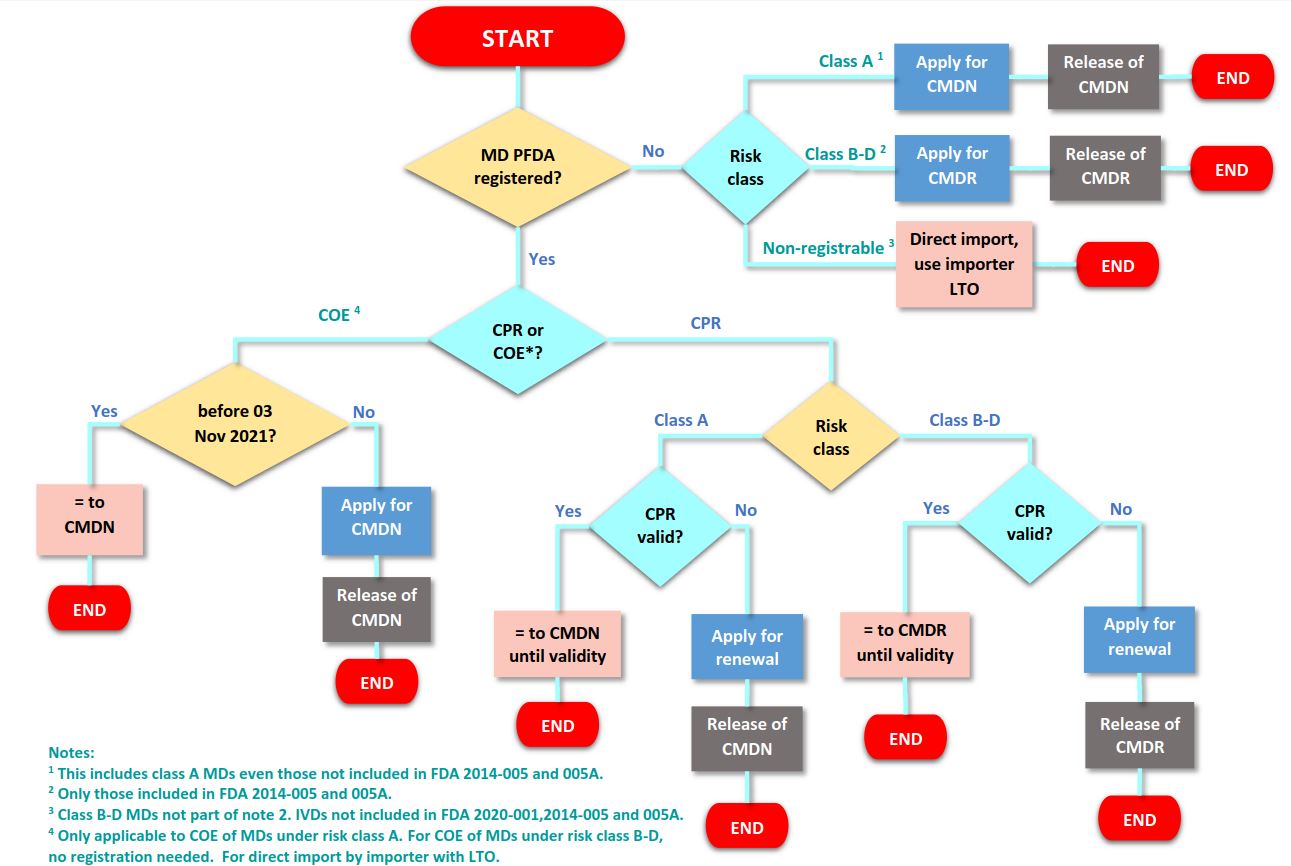
2019 年 4 月 1 日实施的新法规要求进口和投放市场的风险 A 类医疗器械必须持有医疗器械通知证书 (CMDN),风险级别 B、C 和 D 医疗器械必须持有医疗器械注册证书 (CMDR)在菲律宾。新规定将分阶段实施:
目前,所有 A 类医疗器械都必须有 CMDN,所有通知(在 2021-001-A 号通告中列出)B、C 和 D 类医疗器械都必须有 CMDR。
所有未宣布的(未在 2021-001-A 通函中列出)B、C 和 D 类医疗器械必须在 2023 年 4 月 1 日之前拥有初始 CMDN,然后在更新 CMDR 时需要更多参与。
注:最初,未申报医疗器械的截止日期为 2022 年 4 月 1 日,但预计菲律宾 FDA 将延长宽限期。浏览此处了解更多信息。
所有类别的设备都需要国家批准或参考国家批准。

申请材料
原产国医疗器械批准文件
符合 CSDT 模板的技术文件
设备描述、符合性证书、符合性声明、保质期声明和清晰、完整、彩色的标签图片
注册需要额外的文件,例如风险评估和临床证据。
质量体系合格评定
A、B、C 和 D 类设备都需要 ISO 13485 或 FDA 或日本 PMDA 的审核报告,以证明合法和/或实际制造设施的质量体系。

监管效率
菲律宾的医疗器械注册相当简单有效。
菲律宾本国批准要求的例外情况:
严格用于研究、临床试验、展览和/或捐赠的新医疗器械免于申报和注册
使用豁免器械的研究人员和机构必须申请医疗器械营销证书。
有效期和续订
CMDN 和 CMDR 的有效期为 5 年,并且必须在初始批准后每五年更新一次。可以在 CMDR 或 CMDN 到期前 90 天提交续订。
根据旧规则颁发的注册证书 (CPR) 将一直有效,直至到期,届时许可证更新申请将生成一个新的 CMDN,有效期为 5 年,费用为 5,150 菲律宾比索(110 美元)。根据旧规则签发的豁免证书 (COE) 有效期至 2021 年 11 月 3 日,或签发后两年,以较短者为准。






